JURNAL PERCOBAAN IX
“ISOLASI SENYAWA BAHAN ALAM (FLAVONOID)”
NAMA : KELANTAN
NIM : A1C118023
DOSEN PENGAMPU :
Dr.Drs.SYAMSURIZAL, M.Si.
PROGRAM STUDI PENDIDIKAN KIMIA
JURUSAN MATEMATIKA DAN ILMU PENGETAHUAN ALAM
FAKULTAS KEGURUN DAN ILMU PENDIDIKAN
UNIVERSITAS JAMBI
2020
PERCOBAAN IX
I. Judul : Isolasi Senyawa Bahan Alam (Flavonoid)
II. Hari, tanggal : Rabu, 24 November 2020
III. Tujuan
Adapun tujuan dari percobaan ini adalah :
- Dapat menguasai teknik-teknik isolasi bahan alam khususnya Flavonoid
- Dapat mengenal sifat-sifat kimia Flavonoid melalui reaksi-reaksi pengenalan
IV. Landasan Teori
Senyawa flavonoid adalah senyawa polifenol yang mempunyai 15 atom karbon yang tersusun dalam konfigurasi C6-C3-C6, yaitu dua cincin aromatik yang dihubungkan oleh 3 atom karbon yang dapat atau tidak dapat membentuk cincin ketiga. Flavonoid merupakan kandungan tumbuhan hijau dan salah satu senyawa aktif yang menjadi penelitian peneliti dalam mengembangkan obat tradisional Indonesia. Hal penting dari penyebaran Flavonoid dalam tumbuhan adalah adanya kecenderungan kuat bahwa tumbuhan yang secara taksonomi berkaitan akan menghasilkan Flavonoid yang jenisnya serupa (Tim Praktikum Kimia Organik II, 2020).
Flavonoid adalah senyawa yang terdiri dari 15 atom karbon yang umumnya tersebar di dunia tumbuhan.Lebih dari 2000 flavonoid yang berasal dari tumbuhan telah diidentifikasi, tetapi ada tiga kelompok yang umum dipelajari, yaitu antosianin, flavonol, dan flavon. Antosianin (dari bahasa Yunani anthos, bunga dan kyanos, biru-tua) adalah pigmen berwarna yang umumnya terdapat di bunga berwarna merah, ungu, dan biru. Pigmen ini juga terdapat di berbagai bagian tumbuhan lain misalnya, buah tertentu, batang, daun dan bahkan akar. Flavnoid sering terdapat di sel epidermis. Sebagian besar flavonoid terhimpn di vakuola sel tumbuhan walaupun tempat sintesisnya ada di luar vakuola (Lukman, 1995).
Manfaat flavonoid antara lain untuk melindungi struktur sel, meningkatkan efektifitas vitamin C, antiinflamasi, mencegah keropos tulang dan sebagai antibiotik . Sejumlah tanaman obat yang mengandung flavanoid telah di laporkan telah memiliki aktivitas antioksidan, antibakteri, antivirus, antiradang, antielergi dan antikanker, di antaranya tanaman teki dan meniran (Lumbessy, dkk, 2013).
flavonoid mempunyai banyak aktivitas farmakologi dengan masing-masing mekanisme aksi terutama sebagai anti--oksidan dengan mekanisme pemecahan radikal bebas. Dengan dasar struktur flavonoid yang dapat melakukan donor hidrogen pada radikal bebas menjadikannya potensial sebagai anti-oksidan dibandingkan aktivitas farmakologi lain. Kedepannya diharapkan dengan kapasitas in vitro dan in vivo flavonoid yang potensial sebagai anti-oksidan dapat dikembangkan pada industri obat dan makanan sebagai produk dengan kemampuan mencegah radikal bebas (Alfaridz & Amalia, 2016).
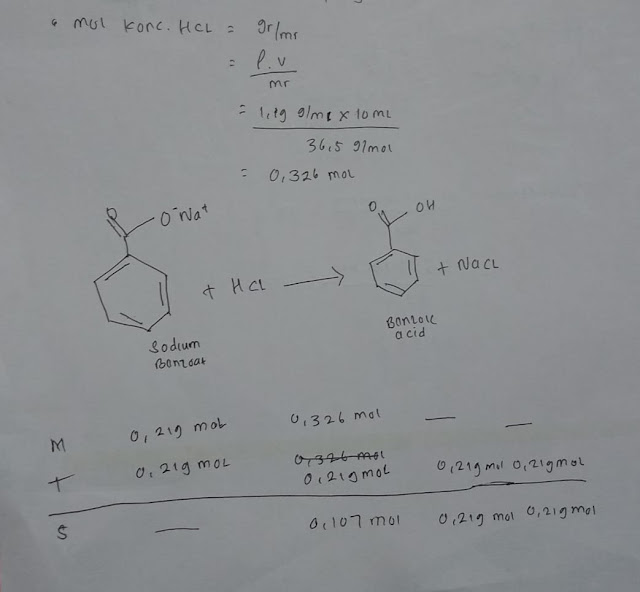
Isolasi senyawa flavonoid dilakukan dengan cara kromatografi kertas preparatif. Mula-mula ekstrak kental n-butanol ditambahkan dengan metanol secukupnya. Kemudian ekstrak tersebut ditotolkan dengan arah memanjang seperti pita pada batas awal eluasi pada kertas Whatman no. 3 sampai jenuh. Selanjutnya kertas preparatif dieluasi menggunakan fase gerak yaitu BAA (n-butanol-asam asetat glasial-air dengan perbandingan 4:1:5), setelah mencapai batas eluasi kertas preparatif diangkat dan dikeringkan. Kemudian masing-masing pita yang terbentuk digunting menjadi potongan-potongan kecil dan diekstraksi dengan metanol (Djamil & Bakriyyah, 2015).
V. Alat dan Bahan
5.1 Alat
- Erlenmeyer 250 ml
- Gelas kimia 200 ml
- Lumpang
- Gelas ukur
- Tabung reaksi 20 bh
- Plat tetes
- Pipet tetes
- Corong gelas
5.2 Bahan
- Pereaksi Deragendrof
- Kloroform
- NaOH padatan
- Pereaksi Meyer
- Etanol
- Iodine
- Pereaksi Wagner
- Metanol
- Brusin
- Shinoda
- Heksa
- KI
VI. Prosedur Kerja
Cara uji teknik Shinoda (Mg + HCl)
- Dimasukkan 0,5 gr simplisia yang telah dilakukan ekstraksi dengan 10 ml etanol
- Dipanaskan selama 5 menit dalam tabung reaksi
- Disaring hasil ekstrak dan ditambahkan filtratnya beberapa tetas HCl pekat
- Ditambahkan lebih kurang 0,2 gr bubuk magnesium. Bila timbul warna merah tua, menandakan contoh kandungan flavonoid.
Cara lain uji Flavonoid
- Ditambahkan ekstrak etanol di atas dengan 2 tetes NaOH 10%. Adanya Flavonoid ditandai dengan perubahan warna kuning-orange merah.
- Digunakan sebutir kecil 8-katekin sebagai pembanding untuk ukuran Flavonoid dalam contoh tumbuhan yang dianggap (++) atau lagundi (+++) untuk jumlah kandungan flavonoid dalam simplisia.
Link video terkait percobaan IX
Permasalahan
- Pada percobaan ini ada yang menggunakan uji KLT dan tidak. Jadi, apa pengaruh dilakukan atau tidak dilakukannya uji KLT terhadap produk yang dihasilkan?
- Apa kegunaan penambahan bubuk Mg pada percobaan ini?
- Apa penyebab lamanya proses ekstraksi dan pengaruh cepat atau lamanya ekstraksi terhadap produk?